Na hodinách chémie sme sa učili že uhlík môže dosahovať maximálne 4 kovalentné väzby, pretože vo svojom najvrchnejšom elektrónovom obale (valenčná vrstva) má k dispozícii 4 elektróny a potrebuje ďalšie 4 aby dosiahol stabilný valenčný oktet.
Pred nedávnom sa však podaril nemeckým vedcom husársky kúsok, keď vytvorili zlúčeninu obsahujúcu jeden atóm uhlíka so 6 kovaletnými väzbami.
Možnosť uhlíka formovať 6-väzbové zlúčeniny bolo teoreticky známe už od roku 1973, avšak na jeho experimentálne potvrdenie sme si museli počkať.
Dôvodom je že nová molekula je stabilná len v extrémne silnej kyseline a pri nízkych teplotách.
Vedci využili zlúčeninu pod názvom mellitene, viď nasledujúci obrázok.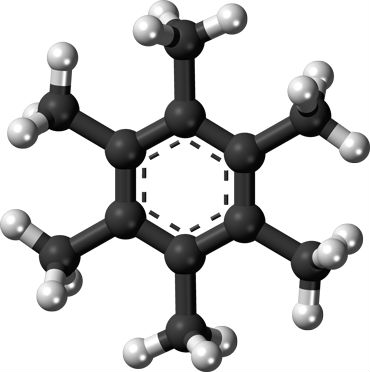
Vedci sa spýtali, čo by sa stalo keby táto zlúčenina prišla o 2 elektróny?
Odpoveď bola že molekula by zmenila svoje priestorové usporiadanie do menej stabilnej pozitívne nabitej formy. Jeden uhlík by preskočil nad stred bezénového jadra a celá molekula by sa "zrútila" do pyramidálnej formy, viď nasledujúci obrázok.
Všimnite si, že v tomto usporiadaní je k dispozícii až 6 elektrónov zo 6 uhlíkov, pre tvorbu kovalentných väzieb pre stredný uhlík.
Treba však poznamenať že nie všetky väzby v tejto zlúčenine sú rovnocenné. 6-väzbový uhlík je oveľa menej stabilný a je výrazne slabšie väzbovaný ako 4-väzbové uhlíky tvoriace zvyšok zlúčeniny. Preto je táto konformácia nestabilná a môže existovať len pri špeciálnych podmienkach (silná kyselina,extrémne nízka teplota).

Uhlík v tomto prípade netvorí klasické elektrónvé väzby ako sme zvyknutí v zmysle donor-akceptor, ale skôr čiastočne zdieľa viacero elektrónov vo viacerých väzbách.
Tieto nové výsledky ukazujú že uhlíkové väzby a chemické väzby vo všeobecnosti sú omnoho zložitejšie a pestrejšie ako sme si doteraz mysleli.
Aktualizácia 27.1.2017:
A máme tu nové informácie z prvej ruky, od fyzikálneho chemika Mariána Galla.
Marián pre nás vygeneroval v programe MoleCoolQt nasledujúci obrázok elektrónovej hustoty molekuly.

"Čo vidíme na obrázku je isosurface elektrónovej hustoty s hodnotou 0.1. V stupnici je zobrazený Lapcian elektrónovej hustoty, ktorý vypovedá o rôznych vlastnostiach molekuly.
Ak je záporný hovorí o úbytku elektrónov a ak je kladný o koncentrácii elektrického náboja, čiže v našom prípade to asi vypovedá o elektronóvých pároch orientovaných v smere toho uhlíka." Marian Gall
Zdroje:
pôvodný vedecký článok, ScienceAlert, Science News, New Scientist,